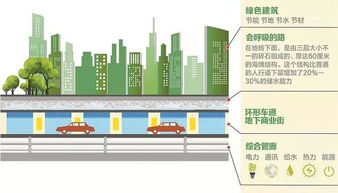
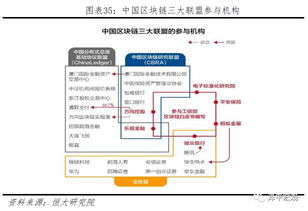
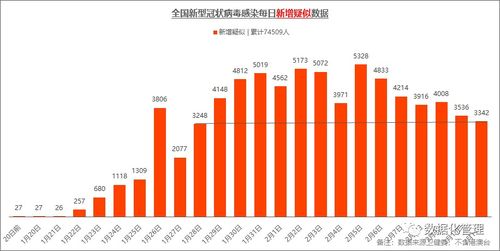
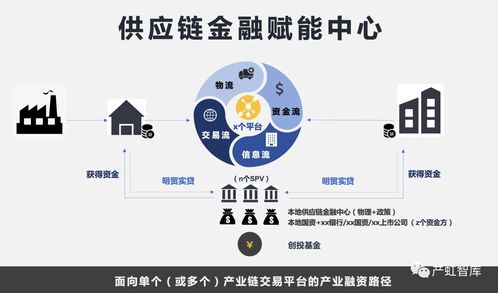
美国血液学年会(ASH)是全球血液学领域规模最大、涵盖最全面的国际学术盛会之一,2021年第63届ASH年会将于12月11日-14日在线下和线上同时举行,聚焦血液疾病前沿研究、提升临床医生诊疗水平。在本次ASH年会中
多项关于奥妥珠单抗在血液肿瘤中应用的研究数据正式公布
,医脉通整理了其中的精华,以飨读者。滤泡性淋巴瘤(FL)
【Oral 814】PrECOG 0403Ⅱ期研究:奥妥珠单抗、维奈克拉、苯达莫司汀联合方案作为高肿瘤负荷(HTB)的FL患者的一线治疗方案的疗效评估
该研究的入组患者为健康状态(PS)和脏器功能良好、未接受过治疗的HTB FL患者。治疗方案为:奥妥珠单抗第1周期静脉注射100mg d1、900mg d2、1000 mg d8和d15,第2-6周期静脉注射100mg d1;维奈克拉第2-6周期口服800mg/d d1-d10;苯达莫司汀静滴 90mg/m2 d1-d2,每28天一个周期,共6个周期。 在2017年12月至2020年11月期间,研究共入组56例患者,其中73.2%(n=41)患者在诱导治疗结束后达到完全缓解(CR),53.5%(n=30)患者进行维持治疗。中位随访20.9个月,
预计94.4%的患者总生存期(OS)可达到2年,85.8%的患者无进展生存期(PFS)可达到2年。
在维持阶段,研究将继续跟踪联合治疗方案的有效性和安全性。【Oral 128】Glofitamab单药递增剂量(SUD)方案与Glofitamab、奥妥珠单抗联合方案,治疗复发或难治性(R/R)FL患者的疗效评估
截至2021年5月18日,该研究Glofitamab单药治疗组入组53例患者,在Glofitamab给药前7天接受奥妥珠单抗(1000mg)治疗,然后分别接受3种不同剂量的SUD治疗;Glofitamab、奥妥珠单抗联合治疗组入组19例患者,在第1周期接受Glofitamab治疗,然后从第2周期d1开始联合奥妥珠单抗(1000mg)治疗,每21天一次,持续12个周期。其中单药治疗组和联合治疗组的高危患者比例分别为53%和58%;难治患者比例分别为53%和42%;CD20和烷化剂化疗双耐药的患者比例分别为30%和37%;24个月内疾病进展(POD24)的患者比例分别为36%和53%。在单药治疗组中,总缓解率(ORR)为81%(n=43),完全代谢缓解(CMR)率为70% (n=37);
在联合治疗组中,ORR为100%(n=19),CMR为73.7% (n=14)
。Glofitamab SUD单药治疗或与奥妥珠单抗联合使用,在R/R FL患者(包括高危亚组,如表1所示)中都取得了高反应率,且安全性可控。最常见的不良事件(AE)是细胞因子释放综合征(CRS),主要发生在第1、2周期,多为1级或2级,≥3级CRS仅有1例。Glofitamab单药SUD方案与Glofitamab联合奥妥珠单抗方案的安全性和有效性还需通过进一步的随访进行评估。 表1单药治疗方案和联合治疗方案在高危亚组患者中的CMR率慢性淋巴细胞白血病(CLL)
【Poster 3753】
微小残留病灶
(
MRD
)评估:泽布替尼、
奥妥珠单抗
、
维奈克拉
(
BOVen
)
联合方案
有限疗程
治疗C
L
L
患者
这项多中心、II期临床试验 (NCT03824483)的入组标准为:初治CLL、ECOG PS ≤2、绝对中性粒细胞计数(ANC)≥1000/uL、血小板 (PLT) ≥75,000/uL。MRD通过流式细胞术(MRD-FC)和免疫测序(MRD-IS)进行评估。该研究共纳入39例患者,其中37例可评估疗效。在26 个月的中位随访中,95%(n=35)的患者达到外周血(PB)MRD阴性(uMRD)-FC,其中33例患者同时达到了uMRD-IS,并在中位时间为10个月后停止治疗。
中位治疗后随访15个月,停止治疗的患者中94%(n=31)仍为uMRD-FC。由此可知,CLL患者在接受BOVen联合方案治疗后,实现了持久的uMRD。
【Poster 2626】
奥妥珠单抗、阿替利珠单抗、维奈克拉联合方案作为CLL患者一线治疗的限时治疗方案
这项II期临床试验(NCT02846623)的入组标准为:年龄≥18岁,脏器功能正常。患者入组后接受奥妥珠单抗、阿替利珠单抗、维奈克拉联合方案治疗,治疗结束后通过CT和骨髓穿刺/活检及MRD(多色流式细胞术,敏感度10-4)评估疗效。2019年7月至2020年12月,研究共入组26例患者,其中73%(n=19)的患者具有未突变的IGHV基因,54%(n=14)的患者基线淋巴结>5cm。
平均随访时间为13.3个月,早期MRD阴性率高,C6结束时骨髓MRD阴性率为76%
【Poster 3725】奥妥珠单抗、苯达莫司汀联合方案作为维奈克拉治疗CLL/小淋巴细胞淋巴瘤(SLL)患者前的减瘤方案的疗效评估
这项开放标签的3b期研究(NCT03406156)的入组标准为:初治CLL/SLL成人患者(17p缺失者除外)、中/高肿瘤负荷。患者入组后最多给予6个以28天为周期的奥妥珠单抗、苯达莫司汀联合方案的治疗,每2个周期后进行疾病再分期。一旦达到低肿瘤负荷,奥妥珠单抗、维奈克拉联合给药5个周期,然后进行维奈克拉单药治疗,使维奈克拉的用药总时长达到1年。
该研究共纳入120例患者,91.6%的患者在减瘤治疗后实现了低肿瘤负荷,ORR为 90%,CR率为 35.8%。MRD可评估患者的uMRD率为98.2%(所有患者为 89.2%)。
研究结果证实了,奥妥珠单抗、苯达莫司汀联合方案是一种有效的减瘤方案。【Poster 1550】维奈克拉、奥妥珠单抗、阿替利珠单抗联合方案治疗Richter转化(RT)患者的疗效评估
这项II期临床试验(NCT02846623)的入组患者为年龄≥18岁、器官功能正常、既往未治疗或R/R 的RT患者,既往接受过维奈克拉治疗的患者被排除在外。从2020年3月至2021年6月,
共纳入8名弥漫性大B细胞淋巴瘤(DLBCL)RT患者,其中7例为新诊断RT的CLL患者,中位随访时间为11.2个月,缓解率为100%。
3例患者在CR后进行了异体干细胞移植(allo-SCT),并获得了uMRD。研究结果证实了,维奈克拉、奥妥珠单抗、阿替利珠单抗联合方案可使既往未治疗的RT患者获得高缓解率。本试验仍在持续进行中,更新的数据将在后续公布。套细胞淋巴瘤(MCL)
【Poster 3540】BOVen联合方案治疗初治TP53突变型MCL患者的疗效与安全性初步分析
这项多中心、II期临床试验(NCT03824483)的入组标准为:未治疗的伴TP53突变MCL、 ECOG PS≤2、ANC>1000/uL、PLT>75,000/uL、血红蛋白(HGB)≥9 。患者入组后以每周期28天给药,研究的主要终点为2年PFS。目前已入组12例患者,包括各种组织学亚型,均为IV期,75%为MIPI评分高危,50%为17p缺失。
中位随访4个月,1例患者疾病进展,11例患者仍在研究中并且持续缓解。
3级治疗相关的不良事件(AE)仅为输液相关反应,发生率为17%(n=2),最常见的治疗相关AE均为1级/2级,包括:输液相关反应、中性粒细胞减少、血小板减少症、恶心、转氨酶升高、皮疹等。根据初步的研究结果,初治的TP53突变型MCL患者对BOVen方案的疗效和耐受性良好。本试验仍在持续进行中,更新的数据将在后续公布。【Poster 3537】1b/2期研究:维奈克拉、伊布替尼、泼尼松、奥妥珠单抗、来那度胺(Vipor)联合方案治疗初治以及R/R MCL患者的疗效与安全性分析
这项1b/2期研究的入组患者包括R/R和初治MCL患者,ViPOR联合方案 21d x 6C,无需进行维持或巩固治疗。所有患者在12d后逐步增加维奈克拉,并进行TLS监测后进入C2。入组患者在第1、2、4和6个周期后进行基线CT、PET、BM和肿瘤活检,在第6个周期后或疑似CR时进行PET扫描。研究目前已纳入11例患者并接受治疗,R/R患者的中位既往治疗次数为3次,无既往接受过维奈克拉或来那度胺治疗的患者。
其中10例患者可评估疗效,ORR为100%,CR率为80%。
使用12天维奈克拉后进行剂量递增,在C2增加至 400mg并在扩展中继续使用,未监测到TLS或DLT。根据初步的研究结果,初治和R/R MCL患者对BOVen方案的疗效和耐受性良好。本试验仍在持续进行中,分子和ctDNA分析的数据将在后续公布。毛细胞白血病(HCL)
【Oral 43】维莫非尼联合奥妥珠单抗治疗新诊断HCL患者的疗效评估
这项多中心、Ⅱ期临床试验(NCT03410875)纳入新诊断的HCL成人患者,患者入组后先接受维莫非尼960mg bid周期28天的治疗;然后接受维莫非尼联合奥妥珠单抗治疗2-4个周期;奥妥珠单抗在第2个周期的第1、8、15天以及第3和4个周期的第1天1000mg静脉注射。
研究共纳入30例患者,27名患者完成了4个月的研究治疗,96%(n=26)的患者达到CR,在没有进一步治疗的情况下,第10个月100%的患者达到CR(n=27)。
27例CR患者中有26例进行了MRD评估,其中96%(n=25)的患者达到了uMRD。中位随访时间为16.7个月,所有患者均持续缓解,无复发。维莫非尼联合奥妥珠单抗是一种很有潜力的无化疗HCL靶向治疗方法,但还需要更长时间的随访来进一步评估其缓解的持久性。小结
血液肿瘤如FL、CLL、MCL等疾病难以治愈,患者在达到缓解后会出现复发,甚至出现反复复发或转化。以单抗奥妥珠单抗为基础的各种联合治疗方案,在进一步提高治疗有效率方面具有巨大的潜力。随着研究的不断深入,有望为广大血液肿瘤患者带来新的治疗希望。
参考文献:[1] Craig A. Portell, et al. 2021ASH. Oral 814.[2] Franck Morschhauser, et al. 2021ASH. Oral 128.[3] Jacob D. Soumerai, et al. 2021ASH. Poster 3753.[4] Nitin Jain, et al. 2021ASH. Poster 2626.[5] Ian W. Flinn, et al. 2021ASH. Poster 3725.[6] Nitin Jain, et al. 2021ASH. Poster 1550.[7] Anita Kumar, et al. 2021ASH. Poster3540.[8] Christopher Melani, et al. 2021ASH. Poster3537.[9] Jae H Park, et al. 2021ASH. Oral43.